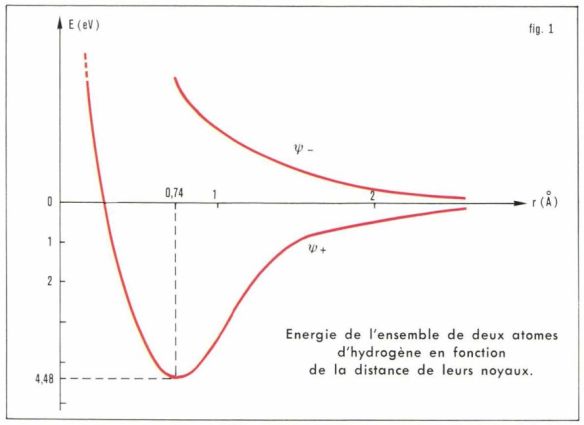
 Liaison covalente = orbitale moléculaire. La mécanique ondulatoire permet de d’expliquer avec une bonne approximation l’énergie et la longueur de la liaison d’une liaison covalente. On considère qu’une liaison entre deux atomes est obtenue par combinaison linaire des orbitales de chaque atome et dont le résultat conduit à la formation d’orbitales moléculaires (OM). Pour la molécule d’hydrogène H2 une orbitale moléculaire est obtenue par combinaison des orbitales atomiques (OA) 1s des deux atomes H. La combinaison linéaire des OA conduit à deux fonctions d’onde ; l’une ψ+, dite symétrique et à laquelle le principe d’exclusion de Pauli fait correspondre deux électrons de spins antiparallèles ; l’autre ψ–, dite antisymétrique. Le calcul de l’énergie de l’ensemble en fonction de la distance des noyaux fait apparaître, suivant qu’on adopte l’une ou l’autre des fonctions d’onde moléculaires, pour ψ– une courbe d’énergie croissante quand la distance diminue — ce qui ne permet aucune liaison — et pour ψ+ une courbe à minimum net pour une certaine distance des noyaux, minimum qui caractérise une position de stabilité pour laquelle les forces d’attraction sont exactement compensées par la répulsion des noyaux. Cette théorie permet de retrouver avec une bonne approximation les résultats expérimentaux : longueur de la liaison H—H, 0,74 Å ; énergie de cette liaison 431,4 kJ/mole.
Liaison covalente = orbitale moléculaire. La mécanique ondulatoire permet de d’expliquer avec une bonne approximation l’énergie et la longueur de la liaison d’une liaison covalente. On considère qu’une liaison entre deux atomes est obtenue par combinaison linaire des orbitales de chaque atome et dont le résultat conduit à la formation d’orbitales moléculaires (OM). Pour la molécule d’hydrogène H2 une orbitale moléculaire est obtenue par combinaison des orbitales atomiques (OA) 1s des deux atomes H. La combinaison linéaire des OA conduit à deux fonctions d’onde ; l’une ψ+, dite symétrique et à laquelle le principe d’exclusion de Pauli fait correspondre deux électrons de spins antiparallèles ; l’autre ψ–, dite antisymétrique. Le calcul de l’énergie de l’ensemble en fonction de la distance des noyaux fait apparaître, suivant qu’on adopte l’une ou l’autre des fonctions d’onde moléculaires, pour ψ– une courbe d’énergie croissante quand la distance diminue — ce qui ne permet aucune liaison — et pour ψ+ une courbe à minimum net pour une certaine distance des noyaux, minimum qui caractérise une position de stabilité pour laquelle les forces d’attraction sont exactement compensées par la répulsion des noyaux. Cette théorie permet de retrouver avec une bonne approximation les résultats expérimentaux : longueur de la liaison H—H, 0,74 Å ; énergie de cette liaison 431,4 kJ/mole.
L’orbitale ψ+, dite liante, correspond à une forte probabilité de présence des électrons de liaison dans l’espace situé entre les noyaux autour de la droite de leurs centres : c’est en effet à la condition d’être la plupart du temps entre les noyaux que les électrons peuvent servir de lien. L’orbitale ψ–, dite anti-liante, correspond au contraire à une faible probabilité de présence des électrons entre les noyaux.
D’une façon générale, une orbitale moléculaire liante est le résultat du recouvrement de deux orbitales atomiques incomplètement occupées : par exemple deux orbitales 1s pour H2, deux orbitales 2p pour Cl2, une orbitale 1s et une orbitale 3p pour HCl. Dans tous ces cas, l’orbitale moléculaire saturée ainsi formée présente la symétrie de révolution autour de la droite des centres. On dit d’une telle liaison formée par recouvrement axial que c’est une liaison σ ; elle est la règle dans le cas d’une liaison simple entre deux atomes. Dans le cas d’une liaison double ou triple, la première liaison est une liaison σ, mais alors la deuxième et la troisième liaison ne peuvent résulter que d’un recouvrement latéral d’orbitales atomiques p par exemple ; l’orbitale ainsi formée présente seulement une symétrie plane ; c’est une liaison π ; son énergie est moindre que celle de la liaison σ.
Liaison d’homo atome (type A-A)
Nous savons que dans les atomes, les électrons se placent autour du noyau et sont représentés par des orbitales (1s, 2s, 2p, etc.) sur différents niveaux d’énergie. Ces orbitales représentent une probabilité de présence d’un électron autour du noyau. La théorie des orbitales moléculaires postule de la même façon que les électrons dans les molécules peuvent exister dans des orbitales d’énergie différentes qui donnent la probabilité de trouver l’électron à des points particuliers autour de la molécule.
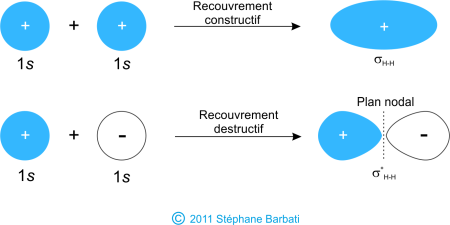
Pour établir l’ensemble des orbitales d’une molécule, il suffit d’additionner les fonctions d’onde de valence atomique des atomes liés (par combinaison linéaire d’OA). Ce n’est pas aussi compliqué que cela puisse paraître. Prenons par exemple la liaison des molécules diatomiques homonucléaires – molécules de la forme A2 : la molécule la plus simple de ce modèle est l’hydrogène, H2. Comme nous l’avons dit, pour établir les orbitales moléculaires de l’hydrogène naturel, on additionne les fonctions d’onde de valence atomique pour former les orbitales moléculaires de l’hydrogène H2. Chaque atome d’hydrogène dans H2 possède une seule orbitale 1s, donc nous additionnons les deux fonctions d’onde 1s. Comme vous le savez, les fonctions d’onde atomiques peuvent avoir des phases soit positive ou négative, ce qui signifie que la valeur de la fonction d’onde est soit positive ou négative. Il ya deux façons d’ajouter des fonctions d’onde, soit en fois en phase (soit + avec + ou – avec -) ou hors-phase (+ avec -). La figure ci-dessous montre comment les fonctions d’onde atomiques peuvent être additionnée pour produire des orbitales moléculaires.
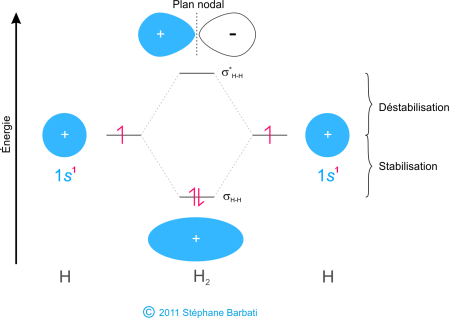
Figure 33 Deux orbitales 1s se combinent pour former un OM liante et anti-liante (cas de H2).
Le recouvrement résultant de la combinaison en phase (+ et +) conduit à la formation d’une orbitale moléculaire, dite liante, et appelée sigma (σH-H). Cette OM fait apparaître une accumulation de densité d’électrons entre les deux noyaux et se traduit par une baisse d’énergie pour cette orbitale. Les électrons occupant les orbitales σH-H représentent la paire des électrons liants.
L’autre orbitale moléculaire produite,σ*H-H, montre une diminution de la densité d’électrons entre les noyaux et atteint une valeur nulle au centre des noyaux que l’on appelle plan nodal. Puisque l’orbitale σ*H-H montre une diminution de la liaison entre les deux noyaux, elle est appelée orbitale moléculaire anti-liante. En raison de la diminution de la densité électronique entre les noyaux, l’orbitale anti-liante est plus élevé en énergie que les orbitales moléculaires de liaison et les orbitales atomiques 1s de l’hydrogène. Dans la molécule H2, aucun électron occupe l’orbitale anti-liante. Pour résumer ces résultats sur les énergies relatives des orbitales atomiques, moléculaires liantes et anti-liantes, nous pouvons dire que la combinaison de 2 OA conduit à la formation de 2 OM, une liante d’énergie inférieure et une anti-liante d’énergie supérieure. Les électrons se répartissent ensuite en respectant le principe d’Aufbau, le principe d’exclusion de Pauli et la règle de Hund. Le diagramme des OM se construit comme suit :
Figure 34 Diagramme d’orbitales moléculaires de l’hydrogène.
Sur le diagramme représenté ci-dessus, les orbitales des atomes séparés sont écrites chaque côté du diagramme sous forme de lignes horizontales en hauteur indiquant leurs énergies relatives. Les électrons dans chaque orbitale atomique sont représentés par des demi-flèches. Au milieu du diagramme, sont représentées les orbitales moléculaires de la molécule. Les lignes pointillées raccordent les orbitales atomiques parentes avec les orbitales moléculaires filles. En général, les orbitales moléculaires liantes sont d’un niveau d’énergie inférieur que celles des orbitales atomiques. De même, les orbitales anti-liantes sont d’un niveau d’énergie plus que celle des orbitales atomiques. Conformément à la règle de la conservation de l’énergie, le degré de stabilisation de l’orbitale liante doit être égal au degré de la déstabilisation de l’orbitale anti-liante.
La détermination de l’ordre d’une liaison permet trouver le nombre de liaisons entre les atomes d’une molécule. L’ordre de liaison est la différence entre le nombre de paires d’électrons occupant les OM anti-liantes et les OM liantes (ou bien ordre de liaison = ½*(nombre d’électrons liants – nombre d’électrons anti-liants)). Sur l’exemple du diagramme l’hydrogène, on observe une paire électronique dans l’OM liante et aucune dans l’OM anti-liante. La théorie des orbitales moléculaires prédit que H2 a un ordre de liaison de un.
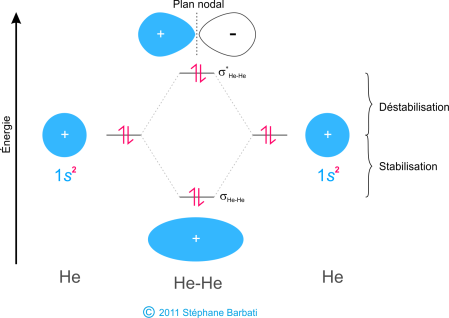
Afin de démontrer pourquoi il est important de prendre en compte le nombre d’électrons anti-liants dans le calcul d’ordre de liaison, prenons l’exemple de la molécule He2. Son diagramme d’OM est le suivant :
Figure 35 Diagramme d’OM de la molécule He2
Sur ce diagramme, on peut remarquer que le degré de stabilisation due à la OM liante est égale à celle de l’OM anti-liante, puisqu’il y a deux électrons dans l’orbitale liantes et deux dans l’orbitale anti-liante. Par conséquent, il n’y a pas de stabilisation nette de l’énergie totale de la molécule. La molécule He2 n’existe effectivement pas. Le calcul de l’ordre de liaison montre qu’il est bien de zéro pour la molécule He2 (1 doublet liant – 1 doublet liant = 0). C’est exactement ce que nous aurions pu prévoir puisque que l’hélium est un gaz noble et qu’il ne forme pas par conséquent de composés covalents.
Voyons maintenant comment construire un diagramme de corrélation pour un système plus complexe, tel que celui du dibore B2. Pour cela nous devons d’abord établir au préalable les combinaisons linéaires des recouvrements des orbitales atomiques du bore. Ensuite, il sera nécessaire de classer les OM obtenues par ordre d’énergie croissante.
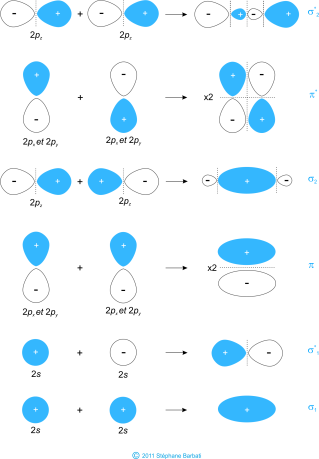
Chaque atome de bore possède une orbitale de valence 2s et trois orbitales de valence 2p. En raison de la grande différence d’énergie entre les orbitales 2s et 2p, nous pouvons ignorer le chevauchement de ces orbitales entre elles. Toutes les OM composées des orbitales 2s toujours seront plus basse en énergie que celle comprenant les orbitales 2p. La figure ci-dessous montre toutes les combinaisons possibles entre les orbitales atomiques.
Le schéma ci-dessous montre le processus de création des OM par combinaison de OA. Notez que les OM de plus basse énergie sont celles dont le recouvrement est le plus constructif (moins de plans nodaux) et que les OM de plus haute énergie sont celles qui présentent le recouvrement le plus destructif
Figure 36 Orbitales moléculaires du dibore
Comme on l’a vu précédemment les OA 2s se combinent pour former 1 OM liante σ et 1 OM anti-liantes σ*. Concernant les OA de type p il y a deux recouvrements possibles. L’une est un recouvrement axial comme le montre la figure avec la combinaison de 2 OA 2pz qui conduite à la formation d’une OM liante de type σ. L’autre recouvrement possible est latéral comme le montre la figure avec la combinaison des deux OA 2px et des deux 2py qui conduit dans ce cas à la formation d’OM liante de type π. La différence entre les OM de type s et celles de type p réside dans leur symétrie. Les OM σ ont une symétrie cylindrique le long de l’axe de liaison que n’ont pas les OM π en raison de l’existence d’un plan nodale sur l’axe de liaison.
Les niveaux d’énergie étant établis, nous pouvons déterminer les niveaux d’énergie de la molécule B2 selon le diagramme ci-dessous.
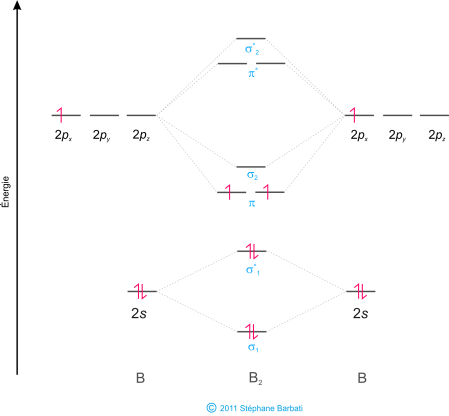
Figure 37 Diagramme moléculaire du dibore.
Le diagramme moléculaire de la molécule B2 n’est pas applicable à toutes les molécules diatomiques homonucléaires (La nature n’étant pas toujours coopérative avec nos théories). Pour les diagrammes d’OM de molécules où la liaison est relativement courte (B2, C2 et N2) les deux OM π ont une énergie inférieure à celle de la σ. Pour tous les atomes de masse atomique supérieure à 7, la liaison π est moins stable (donc de niveau supérieur) que la liaison σ formée par les OA à recouvrement axial. Ainsi, le diagramme suivant du fluor est représentatif de toutes les molécules diatomiques homonucléaires ayant une masse atomique plus grande que 7.
Figure 38 Diagramme moléculaire pour les molécules homonucleaire diatomique autres que B2, C, et N2
Liaison d’hétéro atomes (type A-B)
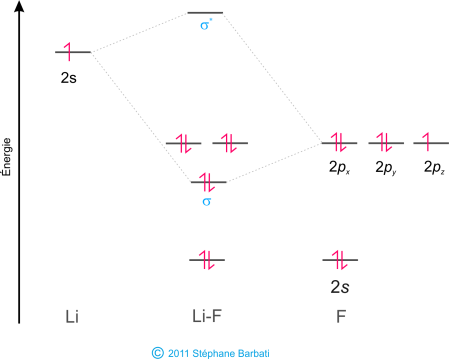
Pour établir les diagrammes moléculaires de molécules hétéroatomiques, il est nécessaire de bien placer les OA des deux différents atomes. Pour cela il faut tenir compte de leur électronégativité respective. Prenons l’exemple des atomes de fluor et de lithium. Le fluor est plus électronégatif que le lithium. Nous avons vu que l’électronégativité est une capacité d’un noyau à attirer les élections vers lui. Ainsi les électrons sont plus stables, c’est-à-dire d’énergie plus basse, quand ils sont sur le fluor comparativement au lithium. Les OA des éléments plus électronégatifs sont placées à une énergie inférieure sur le diagramme des OM que les éléments moins électronégatifs, comme l’indique la figure suivante :
Figure 39 Diagramme des OM de LiF
Puisque le lithium possède une seule orbitale de valence, seule une orbitale moléculaire liante et une anti-liante sont possibles. De plus, les élections dans les orbitales de F qui ne peuvent se lier avec le Li, restent en tant que paires libres, appelées doublet non liants. La Figure 39 montre que les élections de l’OM de la liaison σ sont énergétiquement proches des orbitales 2p du fluor. La combinaison des OA, montre également que l’orbitale liante s est majoritairement composée des OA 2p du fluor. Ainsi le diagramme des OM prédit que la liaison devrait-être polarisée vers l’atome de fluor, comme on le trouve expérimentalement en mesurant le moment dipolaire. Une telle polarisation de la densité électronique vers le fluor représente un transfert d’un électron du lithium vers le fluor et conduit à la formation d’un composé ionique.
La construction des autres diagrammes diatomiques hétéronucléaire suit exactement les mêmes principes que ceux vus ci-dessus pour le LiF.
Liaisons de poly atomes
Pour décrire les liaisons de molécules polyatomiques, il faut tracer des diagrammes avec autant de dimensions qu’il y a de liaisons. Or, ce type de diagramme est trop complexe à réaliser. Une autre méthode, appelée hybridation, permet plus aisément de décrire les liaisons de molécules polyatomiques. En combinant ensemble certaines OA, il est possible de produire une série d’OA hybrides ayant des caractéristiques structurales adaptées (forme et direction) pour rendre compte des angles de liaison des molécules polyatomiques. À chaque orbitale hybride correspond une liaison.
À partir de la géométrie des molécules, telles que prédites par la méthode VSEPR, on peut déduire l’état d’hybridation de l’atome central. Les molécules linéaires sont hybridée sp. Chaque orbitale hybride est une combinaison d’un OA s et d’une OA p sur l’atome central. Les molécules à géométrie triangulaire sont hybridée sp2 (1 OA s + 2 OA p). Les molécules tétraédriques sont hybridées sp3 (1 OA s + 3 OA p).
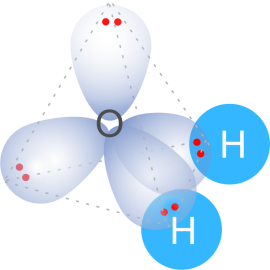
Prenons la molécule d’eau pour illustrer comment les orbitales sont utilisées pour décrire les liaisons. D’après la théorie VSEPR, l’eau est un système AB2E2 (A étant l’atome central, donc l’oxygène ici ; B2 sont les deux doublets liants avec H et E2 les deux doublets non liants de O). La géométrie de la molécule d’eau est donc tétraédrique et est hybridée sp3. Deux orbitales hybrides sur l’oxygène avec chacune un électron peuvent former une liaison avec l’OA 1s de l’hydrogène également occupée par un seul électron. Les deux autres orbitales restantes de l’oxygène possède chacune un doublet non-liant, comme indiqué sur le schéma ci-dessous (Figure 40).
Figure 40 La molécule d’eau possède 4 orbitales hybrides de type sp3. Deux sont liants et sont représentée par deux liaisons s avec les deux atomes H. Deux sont non-liantes et contiennent les deux doublets non-liants de O.


Il y a un cours que vous n’avais pas encore mis sur le site. Pourriez vous le mettre avant les vacances s’il vous plait?
C’est fait.
Bonjour ,
Comment construire un diagramme moléculaire de l’atome WH2+.
Merci
Cordialement
Bonjour,
Le top serait d’avoir une méthode « pas-à-pas pour comprendre comment construire un tel diagramme.. Ca parait tellement compliqué.
Génial ce cours! J’ai pu comprendre rapidement cette notion qu’on nous a bêtement balancé dans mon cours de L1 Paces. Ca fait du bien de comprendre! Merci à vous les schémas sont super 🙂
Je veux les exercices en vidéo.Merci